由小牛医药提供全程临床试验服务的“丙酸氟替卡松乳膏的人体生物等效性研究”已高质量完成!本研究严格遵循监管要求,通过科学量化糖皮质激素引起的局部皮肤血管收缩效应,精准评估受试制剂与参比制剂的生物等效性,为申办方产品上市提供了关键数据支持。
项目背景
丙酸氟替卡松最早于1990年在美国上市,原研企业为葛兰素史克(GSK plc),常用剂型有气(喷)雾剂、软膏剂、雾化吸入用混悬剂等,其中丙酸氟替卡松乳膏(GlaxoWellcome UK Limited持证)2019年在我国上市,商品名为Cutivate®。FDA于2022年颁布的指导原则《皮肤局部用皮质类固醇:体内生物等效性的供企业用的指导原则草案》建议,拟使用体内药效学方法证明试验的局部皮质类固醇与其参比制剂的生物等效性的,进行两项体内血管收缩研究:(1)使用参比制剂进行探索性给药-持续时间血管收缩反应研究;(2)比较试验的局部皮质类固醇和参比制剂的关键性的血管收缩生物等效性研究。
研究设计
初步的剂量持续时间-效应研究
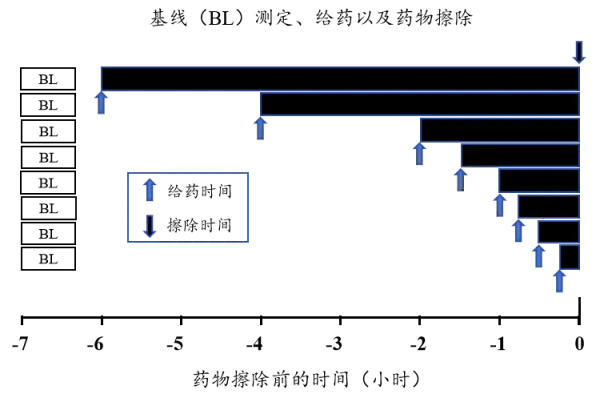
初步的剂量持续时间-效应研究采用参比制剂进行随机、持续给药设计,旨在探索给药持续时间-效应关系,并为后续关键性研究确定最佳给药持续时间。
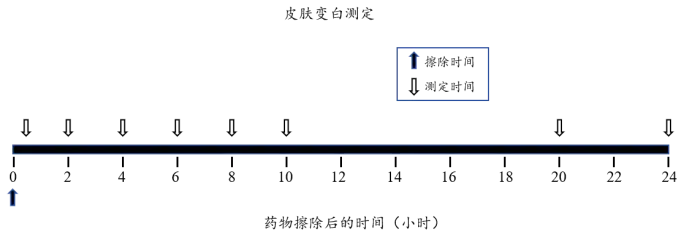
研究中设立未经治疗的对照部位(UNT),用于校正活性药物作用部位的皮肤颜色变化。需设定一系列适当的给药持续时间梯度(如0.25~6.0小时,具体范围可根据所研究的皮质类固醇调整;见下图)。在清除皮肤残留药物后,于每个给药时间点结束时,使用分光光度计测量皮肤反应,并计算效应曲线下面积(AUEC)来量化药效学响应。
应用非线性混合效应模型对剂量持续时间-效应数据进行建模分析,估算ED50值。该ED50值将作为关键性血管收缩生物等效性研究中近似给药持续时间的选择依据。
关键性BE研究
采用探索性研究确定的 ED50值作为受试制剂(T)与参比制剂(R)的单次给药持续时间。此外,关键性研究中还应包括参比制剂的每个给药持续时间(D1和D2)的重复。
试验部位分配方案如下:
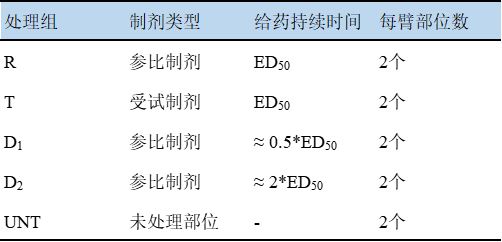
对于生物等效性分析,可评价受试者需同时满足:①剂量响应验证:D₂部位平均参比AUEC / D₁部位平均参比AUEC ≥ 1.25。②药效方向性:D₁与D₂部位的AUEC均为负值(体现血管收缩效应)。使用Locke氏法,计算90%置信区间用于试验药的平均AUEC效应(4次重复测定的平均值)和对照药的平均AUEC效应(4次重复测定的平均值)的比率。
核心结果
受试制剂-丙酸氟替卡松乳膏(规格:0.05% 15g:7.5mg/支)与GlaxoSmithKline (Ireland) Limited为持证商的参比制剂-丙酸氟替卡松乳膏(商品名:Cutivate®,规格:0.05% 15g:7.5mg/支)AUEC0.5-24比值的90%置信区间落在80.00%~125.00%范围内,生物等效性成立。健康受试者局部给与丙酸氟替卡松乳膏的安全性和耐受性良好。
编辑:聂茹佳
审核:宫雪
批准:陈亚红



